Transplantation menschlicher Photorezeptorzellen in Netzhäute von Mäusen
Dresdner Forschende haben eine effiziente Methode entwickelt, um eine hohe Anzahl menschlicher Photorezeptorzellen zu produzieren und diese zur Wiederherstellung der Wahrnehmung von Tageslicht bei Mäusen mit degeneriertem Sehvermögen einzusetzen.
Die Transplantation von Photorezeptorzellen ist ein vielversprechender Eingriff, der in Zukunft dazu beitragen könnte, das Sehvermögen von Menschen mit Erblindungskrankheiten wiederherzustellen. Ein Forschungsteam unter der Leitung von Prof. Marius Ader vom Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden hat in einer neuen Studie, die im „Journal of Clinical Investigations" veröffentlicht wurde, einen weiteren präklinischen Fortschritt erzielt. Das Team entwickelte eine effiziente Methode zur Herstellung menschlicher Photorezeptorzellen. Die Forschenden zeigten, dass die menschlichen Photorezeptoren in großer Zahl in teilweise degenerierte Mäusenetzhäute eingebaut werden können. Die inkorporierten Photorezeptoren entwickelten die Eigenschaften normaler Photorezeptoren und stellten die Wahrnehmung von Tageslicht in Mäusen mit geschädigtem Sehvermögen wieder her.
Die neue Studie ist ein weiterer Schritt, um Transplantationen von Photorezeptoren zu ermöglichen und Zellersatztherapien für Patienten und Patientinnen mit Erblindungskrankheiten zu entwickeln. „Unseres Wissens nach ist dies das erste Mal, dass jemand eine so umfassende Integration von transplantierten Photorezeptoren in der Netzhaut erreicht hat", sagt Prof. Marius Ader, Forschungsgruppenleiter am Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden, der die Studie leitete.
Alter der transplantierten Photorezeptoren entscheidend
Um die Zahl der in die Netzhaut integrierten Photorezeptoren massiv zu erhöhen, optimierten die Forschenden mehrere kritische Faktoren. Sie stellten fest, dass das Alter der transplantierten Photorezeptoren entscheidend ist. „Es ist uns gelungen, das perfekte Stadium für die Übertragung der Photorezeptoren in die Netzhaut zu finden. Wenn wir jüngere oder ältere Photorezeptoren verwenden, sehen wir einen starken Rückgang der Einbaurate", sagt Prof. Ader.
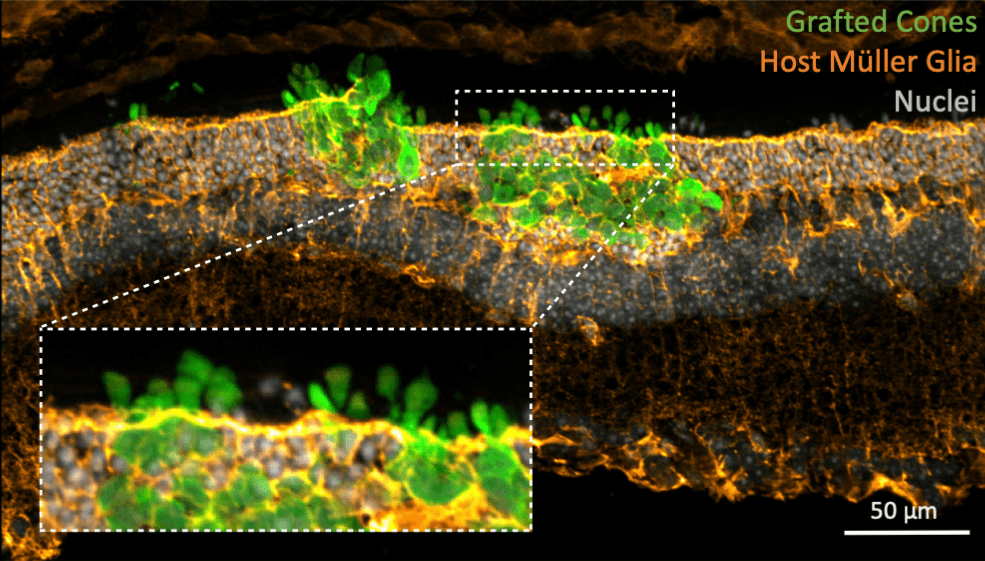
Transplantierte menschliche Zapfenphotorezeptoren (in grün) werden in die degenerierte Netzhaut der Maus inkorporiert. Unterstützende Zellen in der Wirtsnetzhaut (Müller-Glias, in orange) interagieren eng mit dem Transplantat. Bild mit Genehmigung von JCI angepasst. © JCI
Das Team fand auch heraus, dass die Integration in die Netzhaut eine längere Zeit benötigt. „Wir haben gesehen, dass die Photorezeptorzellen viel Zeit brauchen – bis zu sechs Monate – um mit den verbleibenden Zellen in der Mäusenetzhaut zu interagieren und ein geeignetes Netzwerk aufzubauen", sagt Prof. Ader.
Die Interaktion mit den verbleibenden, nicht geschädigten Zellen in der Mäusenetzhaut erwies sich als Schlüsselfaktor. „Etwa 30 % der Zellen in der Netzhaut sind andere Zellen, die die Arbeit der Photorezeptoren unterstützen. Wir haben gesehen, dass die Interaktion der transplantierten Zellen mit den Zellen der Netzhaut des Wirts entscheidend für die erfolgreiche Eingliederung und Reifung war. Einige dieser verbleibenden Zellen boten ein Gerüst für die neuen Photorezeptoren und halfen ihnen, sich richtig zu organisieren", fügt Prof. Ader hinzu.
Effiziente und unbegrenzte Quelle für Photorezeptoren
Zur Herstellung von Photorezeptoren verwendete das Team Stammzellen, um Mini-Retinas in der Laborschale zu züchten, und zwar nach einem von ihrem Kollaborationspartner Prof. Mike Karl entwickelten Protokoll. Sobald die Mini-Retinas das erforderliche Stadium erreicht hatten, entnahmen Dr. Sylvia Gasparini und Karen Tessmer, die Wissenschaftlerinnen im Team von Prof. Ader, die die meisten Experimente in dieser Studie durchführten, die Photorezeptoren zur Transplantation.
„Eine weitere Herausforderung ist die Gewinnung einer Spenderzellpopulation, die größtenteils aus Photorezeptoren besteht. Um dies zu erreichen, hat unser Kollaborationspartner Prof. Volker Busskamp eine neue Stammzelllinie entwickelt, bei der die Zapfen-Photorezeptorzellen mit speziellen Markierungen versehen sind. Diese Markierungen beeinträchtigen nicht ihre Funktion, aber ermöglichen es uns, die Photorezeptoren effektiv von den übrigen Zellen in den Mini-Retinas zu trennen", erklärt Prof. Ader.
Solche induzierten pluripotenten Stammzelllinien stellen eine praktisch unbegrenzte Quelle zur Herstellung von Photorezeptoren dar und können potentiell für künftige therapeutische Anwendungen genutzt werden.
Tagsicht wiederherstellen
In dieser Studie konzentrierte sich das Team auf Mäuse mit teilweise degenerierten Netzhäuten, denen nur eine von zwei Arten von Photorezeptoren fehlte. „Die Mäuse hatten nur geschädigte Zapfen, die für das Sehen bei Tageslicht verantwortlich sind, eine Situation, die mit mehreren Erblindungskrankheiten bei menschlichen Patienten und Patientinnen vergleichbar ist", erklärt Prof. Ader. Der Ansatz unterschied sich von früheren Studien, weil die übrigen Zellen in der Netzhaut nicht geschädigt waren. Bisher waren die meisten Transplantationsversuche auf Modelle für Erblindungskrankheiten in einem sehr späten Stadium ausgerichtet, die durch die Degeneration aller Photorezeptoren gekennzeichnet sind.
Zusammen mit Expertinnen und Experten am Naturwissenschaftlichen und Medizinischen Institut in Tübingen, der Universität Bonn, dem Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE) Dresden, dem DRESDEN-concept Genome Center und den Elektronen- und Lichtmikroskopie-Einrichtungen am Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden hat das Team eine Vielzahl von Techniken eingesetzt, um die Reifung und Funktion der transplantierten Photorezeptoren gründlich zu überprüfen. Sie konnten nachweisen, dass die neuen Photorezeptoren nicht nur die physiologischen Eigenschaften normaler Photorezeptoren annehmen, sondern auch, wie ihr Kollaborationspartner Prof. Günther Zeck zeigte, korrekt funktionieren und Signale an die nachgeschalteten Nervenzellen in der Netzhaut liefern.
Ein neues Paradigma?
„Wir waren begeistert, wie gut die Photorezeptoren dank der Unterstützung durch die Zellen der Wirtsmaus eingebaut wurden. Dieser Zusammenhang sollte in zukünftigen Transplantationsansätzen bedacht werden. Vielleicht könnte eine Intervention zu einem Zeitpunkt, an dem die Netzhaut noch in der Lage ist, mit dem Photorezeptortransplantat sinnvoll zu interagieren, auch bei Patientinnen und Patienten zu einem positiven Ergebnis führen", schließt Prof. Ader.
Über das Zentrum für Regenerative Therapien Dresden (CRTD)
Am Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden widmen sich Spitzenforscher und -forscherinnen aus mehr als 30 Ländern neuen Therapieansätzen. Sie entschlüsseln die Prinzipien der Zell- und Geweberegeneration und ergründen deren Nutzung für Diagnose, Behandlung und Heilung von Krankheiten. Das CRTD verknüpft Labor und Klinik, vernetzt Wissenschaft und Klinik, nutzt Fachwissen in Stammzellforschung, Entwicklungs- und Regenerationsbiologie, um letztlich die Heilung von Erkrankungen wie Alzheimer und Parkinson, hämatologischen Krankheiten wie Leukämie, Stoffwechselerkrankungen wie Diabetes sowie Augen- und Knochenerkrankungen zu erreichen.
Das CRTD wurde 2006 als Forschungszentrum der Deutschen Forschungsgemeinschaft (DFG) gegründet und bis 2018 als DFG-Forschungszentrum, sowie als Exzellenzcluster gefördert. Seit 2019 wird das CRTD mit Mitteln der TU Dresden und des Freistaates Sachsen finanziert.
Das CRTD ist eines von drei Instituten der zentralen wissenschaftlichen Einrichtung Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden.
Forschungsgruppe Ader
Die Degeneration der Netzhaut durch den Verlust von Photorezeptoren stellt eine der Hauptursachen für Behinderungen in den Industrieländern dar, und es gibt bis heute keine wirksamen Behandlungen. Die experimentellen Arbeiten der Forschungsgruppe von Prof. Marius Ader konzentrieren sich auf die Entwicklung von zellbasierten Strategien zum Ersatz verloren gegangener Zellen in der Netzhaut, einschließlich der Photorezeptoren und des retinalen Pigmentepithels (RPE).
Originalpublikation
Sylvia J. Gasparini, Karen Tessmer, Miriam Reh, Stephanie Wieneke, Madalena Carido, Manuela Völkner, Oliver Borsch, Anka Swiersy, Marta Zuzic, Olivier Goureau, Thomas Kurth, Volker Busskamp, Günther Zeck, Mike O. Karl, Marius Ader: Transplanted human cones incorporate and function in a murine cone degeneration model. The Journal of Clinical Investigations (June 2022)