Feuchte AMD: Europäische Arzneimittelagentur trifft zwei Entscheidungen
Der Ausschuss für Human-Arzneimittel der Europäischen Arzneimittelagentur EMA hat das Biosimilar Ranivisio zur Behandlung von feuchter AMD zur Zulassung empfohlen. ADVM-022, eine einmalige intravitreale Injektion zur Behandlung von feuchter AMD, erhielt von der EMA den Priority-Medicines (PRIME)-Status.
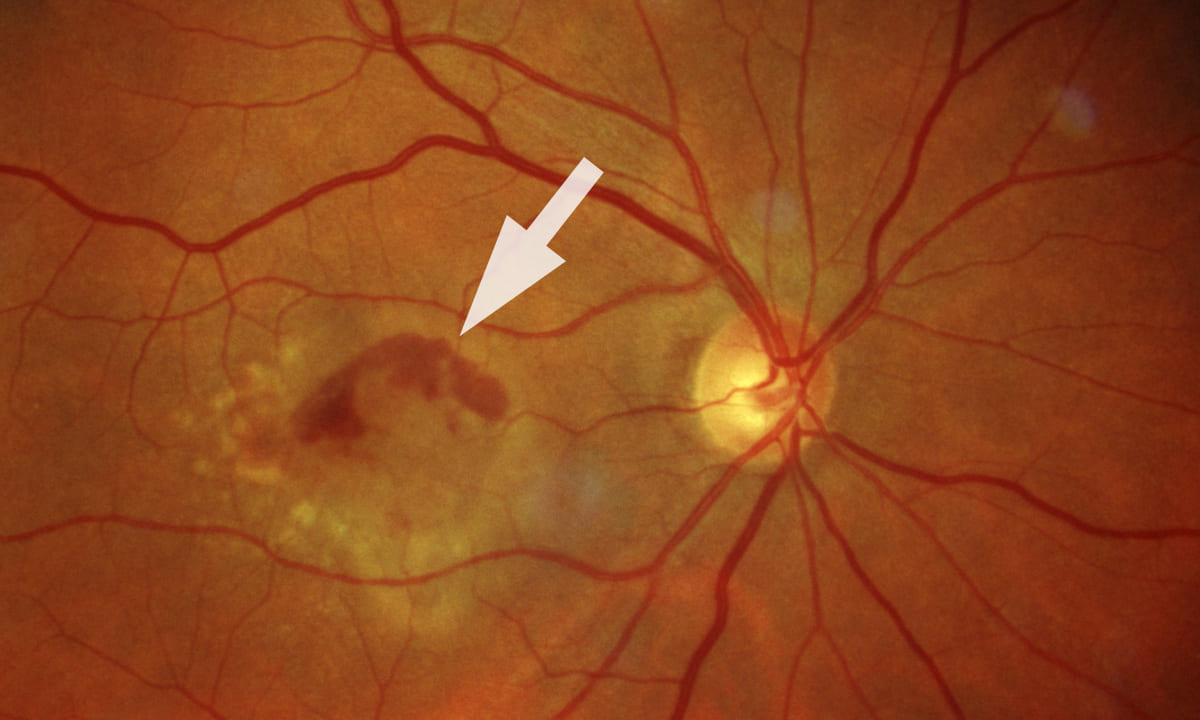
Der Ausschuss für Human-Arzneimittel der Europäischen Arzneimittelagentur EMA hat in seiner Juni-Sitzung neun Arzneien zur Zulassung empfohlen, darunter auch das Biosimilar Ranivisio von Midas Pharma. Sein Wirkstoff Ranibizumab ist ein monoklonales Antikörperfragment. Der VEGF-Hemmer wird intravitreal injiziert.
Ranivisio erhielt ein positives Votum für die Behandlung von Erwachsenen mit feuchter AMD, Sehbehinderung aufgrund eines Makulaödems oder choroidaler Neovaskularisation und proliferativer diabetischer Retinopathie. Effektivität und Sicherheit von Ranivisio seien mit der von Lucentis von Novartis vergleichbar, so die EMA.
Das kalifornische Unternehmen Adverum Biotechnologies hat bekannt gegeben, dass die EMA dem Medikament ADVM-022 den Priority-Medicines (PRIME)-Status für die Behandlung der feuchten AMD verliehen hat. ADVM-022 (AAV.7m8-aflibercept) ist ein Gentherapieprodukt, das nur einmal intravitreal injiziert wird. Das Medikament würde die Behandlungslast bei Patienten mit feuchter AMD, die eine Anti-VEGF-Therapie erhalten, extrem verringern. Eine Phase-2-Studie ist in Planung, um die optimale Wirkstoffdosis zu ermitteln.
Das PRIME-Programm (PRIority Medicines Scheme) wurde 2016 von der EMA eingeführt, um neue Arzneimittel für einen ungedeckten Bedarf und/oder mit bedeutendem therapeutischem Vorteil im Vergleich zu bestehenden Behandlungsoptionen (Priority Medicines) schneller verfügbar zu machen. Dabei wird Entwicklern ein frühzeitiger Zugang zum bestehenden Instrumentarium der Agentur gewährt wird.
Quellen:
EMA:
Summary of opinion: Ranivisio
PRIME: priority medicines
Recommendations on eligibility to PRIME scheme