Förderung für AMD-Projekt der Universitätsaugenklinik Bonn
Eine verbesserte Diagnostik kann die Erforschung neuer Therapieoptionen bei altersabhängiger Makuladegeneration (AMD) ermöglichen. Daran arbeitet ein deutsch-US-amerikanisches Forscherteam: Ein innovatives Bildgebungsverfahren soll zur Definition neuer klinischer Marker zur Therapieüberwachung genutzt werden.

Die AMD führt bei Millionen älterer Menschen zum Verlust des zentralen Sehvermögens. Die zugrundeliegenden Veränderungen, insbesondere in den frühen und intermediären Stadien der Netzhauterkrankung, sind bislang nicht therapierbar.
„Hier kommt zum einen die sogenannte Fundusautofluoreszenz (FAF), eine spezielle Darstellung des Augenhintergrundes mithilfe von Blaulicht, und zum anderen eine Schicht, die in Verbindung zur Netzhaut steht, und als retinales Pigmentepithel (RPE) bezeichnet wird, ins Spiel“, so PD Dr. Thomas Ach, leitender Oberarzt und stellvertretender Klinikdirektor der Augenklinik am Universitätsklinikum Bonn (UKB). „Jede Zelle des RPE hat hunderte körnchenartiger Granula in ihrem Zellkörper, die für die spezielle Darstellung, u. a. mit Blaulicht, nutzbar gemacht werden können.“
AMD-Pathologie auf zellulärer Ebene
„Diese Untersuchungen in einer ersten Förderperiode haben bereits wesentlich zum Verständnis der altersabhängigen Veränderung und AMD-Pathologie auf zellulärer Ebene beigetragen“, so PD Dr. Ach weiter. Eine neue Erkenntnis aus der in seiner Arbeitsgruppe angewendeten hochauflösenden Mikroskopie ist, dass die Granula sich in RPE-Zellen im Bereich der Stelle des schärfsten Sehens anders verteilen als außerhalb. Dies konnte in Kooperationsprojekten auch mittels anderer bildgebender Verfahren (u. a. Massenspektrometrie und Nachweis spezifischer Lipidsignale) bestätigt werden.
In der nun bewilligten neuen Förderung werden unter Verwendung menschlicher Spenderaugen unterschiedlichen Alters und AMD-Stadien Techniken eingesetzt, um noch höher aufgelöst und detaillierter die Signalquellen für die FAF-Bildgebung mit Blaulicht zu analysieren. Das multidisziplinäre Vorgehen soll anschließend für die genauere Diagnostik am lebenden Menschen und zur Definition neuer klinischer Marker zur Therapieüberwachung und therapeutischen Ansätzen zur Behandlung der AMD genutzt werden. Die National Institutes of Health und das National Eye Institute (USA) fördern das aussichtsreiche Projekt nun mit 2,3 Millionen US-Dollar.
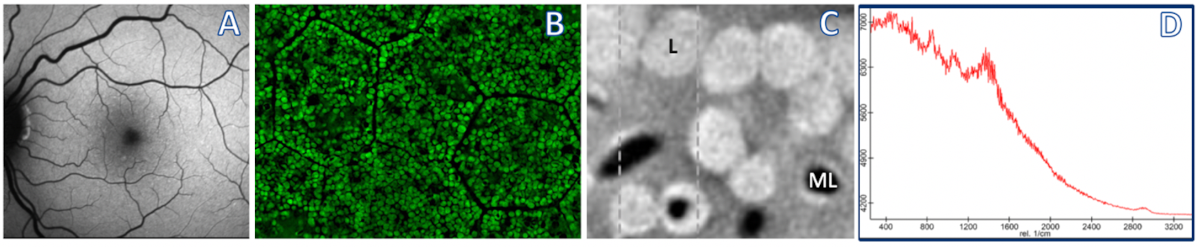
Die klinische Fundusautofluoreszenz (A, Anregung im blauen Wellenlängenbereich) wird routinemäßig in der Netzhaut-Diagnostik eingesetzt. Hauptquelle des Autofluoreszenz-Signals ist dabei das polygonal angeordnete Retinale Pigmentepithel (B), und hier die darin liegenden Lipofuszin (L)- und Melanolipofuzsin (ML)-Granula (C). Mit den von Priv.-Doz. Dr. Ach eingesetzten Methoden lassen sich auch auf subzellulärer Ebene Emissionsspektren einzelner Granula (D, Durchmesser 1µm) darstellen, die wiederum in der Beurteilung von spektralen in vivo Untersuchungen und der Pathogenese von Netzhautveränderungen, insbesondere der altersbedingten Makuladegeneration (AMD), von Bedeutung sind. Panel B ist Teil einer Abbildung aus: Ach et al. Investigative Ophthalmology & Visual Science May 2015, Vol.56, 3242-3252.
Hyperspectral Retinal Autofluorescence Team (HYRAFT) gegründet
Die Antragsteller PD Dr. Ach (Bonn), Professor Curcio (Birmingham, AL, USA) und Professor Schey (Nashville, TN, USA) haben zudem bereits das Hyperspectral Retinal Autofluorescence Team (HYRAFT) gegründet, ein deutsch-US-amerikanisches, multidisziplinäres Konsortium, das sich seit mehr als acht Jahren regelmäßig zu Daten, Ideen und wissenschaftlichen Erkenntnissen über die Biologie, Technologie und klinische Anwendungen der FAF austauscht.
„Die Projekte von PD Dr. Ach werden auf zellulärer und subzellulärer Ebene die FAF weiter aufklären und knüpfen damit hervorragend an die seit Jahren national und international beachtete Forschung zu innovativen Imaging-Methoden der Netzhaut FAF am Standort Bonn an“, so Prof. Frank G. Holz, Direktor der Augenklinik am UKB. „Wir rechnen hier in den nächsten Jahren mit weiteren wichtigen neuen Erkenntnissen und Impulsen, die die AMD-Forschung voranbringen werden.“