Grundlagenforschung an der Netzhaut: Potenzieller Mechanismus für neurodegenerative Erkrankungen entdeckt
Dank einer neuen Generation von Netzhaut-Organoiden konnten Forschende aus Dresden komplexe Veränderungen der Netzhaut beobachten, wie sie etwa bei der AMD auftreten. Dabei entdeckten sie die Zell-Extrusion als neuen potenziellen Mechanismus für neurodegenerative Erkrankungen.
Wissenschaftler:innen aus Dresden haben ein Forschungsmodell entwickelt, das neue Möglichkeiten für die Untersuchung von Sehverlust eröffnet. Es handelt sich um die ersten Netzhaut-Organoide, die wichtige Merkmale der Makula aufweisen. Damit haben die Forschenden einen Weg gefunden, komplexe krankhafte Veränderungen in der Netzhaut hervorzurufen und einen bisher unbekannten Mechanismus des Sehverlusts zu beschreiben. Die Netzhaut-Organoide bieten ein potenzielles erstes Modell zur Untersuchung der altersbedingten Makuladegeneration (AMD) in einem menschlichem Netzhaut-Modell. Die Arbeit unter der Leitung von Prof. Mike O. Karl vom Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden und dem Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) wurde in der Zeitschrift Nature Communications veröffentlicht.
Der Verlust von Zapfen-Photorezeptorzellen ist das Schlüsselsymptom von Erkrankungen wie der altersbedingten Makuladegeneration (AMD). „Es wird geschätzt, dass jeder vierte Mensch über 60 Jahren an AMD leidet, mit derzeit etwa 67 Millionen Patient:innen in Europa", sagt Prof. Karl.
Neue Generation von Netzhaut-Organoiden
Da die Makula nur beim Menschen vorkommt, ist die Untersuchung von Makulaerkrankungen in Tiermodellen nicht optimal. „Zusammen mit meinem Team haben wir nun ein neues menschliches Netzhaut-Modell entwickelt, das mehrere Merkmale einer Schlüsselregion der menschlichen Makula reproduziert. Wir zeigen zum ersten Mal, dass ein solches Modell die Untersuchung von krankhaften Veränderungen ermöglicht, die bei Krankheiten wie AMD auftreten", fügt Prof. Karl hinzu.
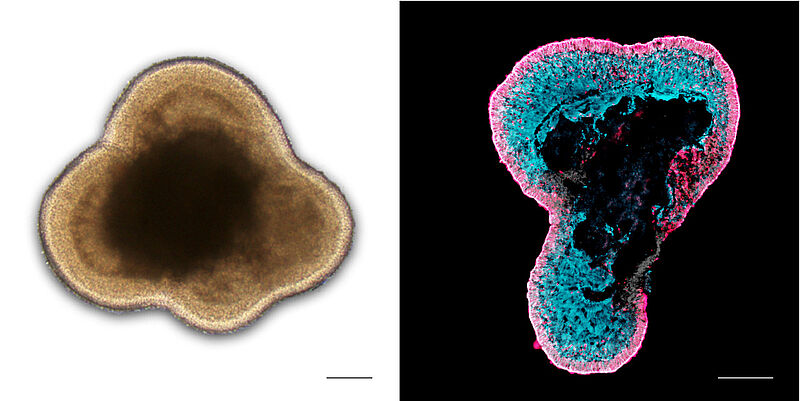
Humane Netzhaut-Organoide. L: Lichtmikroskopisches Bild. R: Gewebeschnitt nach Immunofärbung zeigt Photorezeptoren (rot) und Müller Gliazellen (blau). Bild: DZNE / Karl
Die neue Generation von Netzhaut-Organoiden, die von Prof. Karl und seiner Gruppe entwickelt wurde, ist reich an Zapfen-Photorezeptoren und reproduziert mehrere Schlüsselparameter einer Unterregion der Makula, der so genannten Parafovea, in der die AMD beginnt. „Zum ersten Mal haben wir ein Modell mit einigen Merkmalen einer entscheidenden Region der menschlichen Netzhaut. Wir zeigen, dass diese Organoide verwendet werden können, um komplexere Pathologien des Sehverlusts zu untersuchen."

Prof. Dr. Mike O. Karl. Bild: DZNE
„Bisher entsprachen Netzhaut-Organoide meist den peripheren Teilen der menschlichen Netzhaut. Teile der Makula - der Schlüsselregion für das hochauflösende Sehen - wurden nicht abgebildet", erklärt Prof. Karl. „Im Vergleich zu anderen Teilen der Netzhaut hat die Makula viele spezielle Eigenschaften. Wir gehen davon aus, dass sich krankhafte Veränderungen dort anders entwickeln könnten."
Interaktion zwischen verschiedenen Zelltypen
Die Forschung zeigt, dass Photorezeptoren nicht die einzige Art von Zellen sind, die bei Sehkraftverlust nicht mehr richtig funktionieren. „Die Nachbildung der Interaktion zwischen mehreren verschiedenen Zelltypen macht es schwierig, Sehkraftverlust zu untersuchen und - letztendlich - zu verstehen und zu heilen", so Prof. Karl.
Die Forschenden entdeckten, dass zwei Proteine, HBEGF und TNF (HT), komplexe pathologische Veränderungen in den Netzhaut-Organoiden hervorrufen. Die HT-Proteine wurden bereits früher bei neurodegenerativen Erkrankungen nachgewiesen, aber es war nicht bekannt, dass sie ausreichen, um eine Pathologie zu verursachen. „Wir haben einen fortschreitenden Verlust von Photorezeptorzellen beobachtet. Darüber hinaus sahen wir parallele Veränderungen bei anderen Zellen der Netzhaut, insbesondere bei Müller-Glia. Sie begannen sich zu teilen und bildeten narbenartige Läsionen, die die verlorenen Photorezeptoren ersetzten", sagt die Hauptautorin der Studie Dr. Manuela Völkner.
Netzhautdegeneration im Zeitraffer
„All dies sind Merkmale der Netzhautdegeneration bei AMD und der Schäden, die im Spätstadium der meisten anderen Netzhauterkrankungen beobachtet werden. Während diese Prozesse bei Patient:innen Jahre brauchen, um sich zu entwickeln, haben wir vergleichbare Veränderungen in Photorezeptoren und Gliazellen innerhalb eines einzigen Monats reproduziert", fügt Dr. Völkner hinzu. Das Team glaubt, dass diese Veränderung des Zeitrahmens für die Untersuchung von Krankheitsmechanismen von Vorteil ist. Dadurch können die Dynamik der krankhaften Veränderungen und die Ergebnisse möglicher Eingriffe schneller beobachtet werden.
Photorezeptoren verschwinden
Nach der Stimulation mit HT-Faktoren verschwanden zahlreiche Photorezeptoren in den Organoiden. „Wir haben beobachtet, dass Photorezeptoren verloren gehen, konnten aber in der Netzhaut keinen Zelltod feststellen“, erklärt Prof. Karl. „Die Hälfte aller Photorezeptoren ist innerhalb von zehn Tagen aus dem Netzhaut-Organoid verschwunden, aber offenkundig sind sie nicht in der Netzhaut gestorben. Das hat uns neugierig gemacht.“
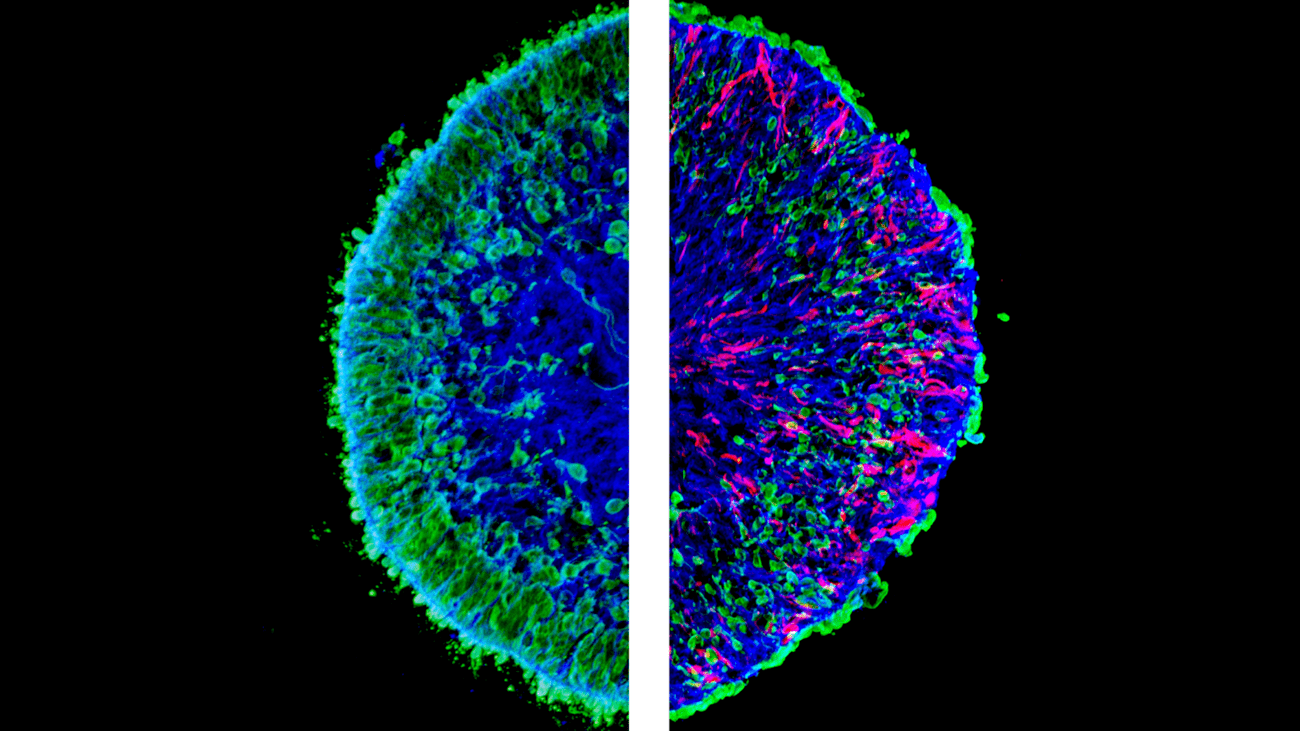
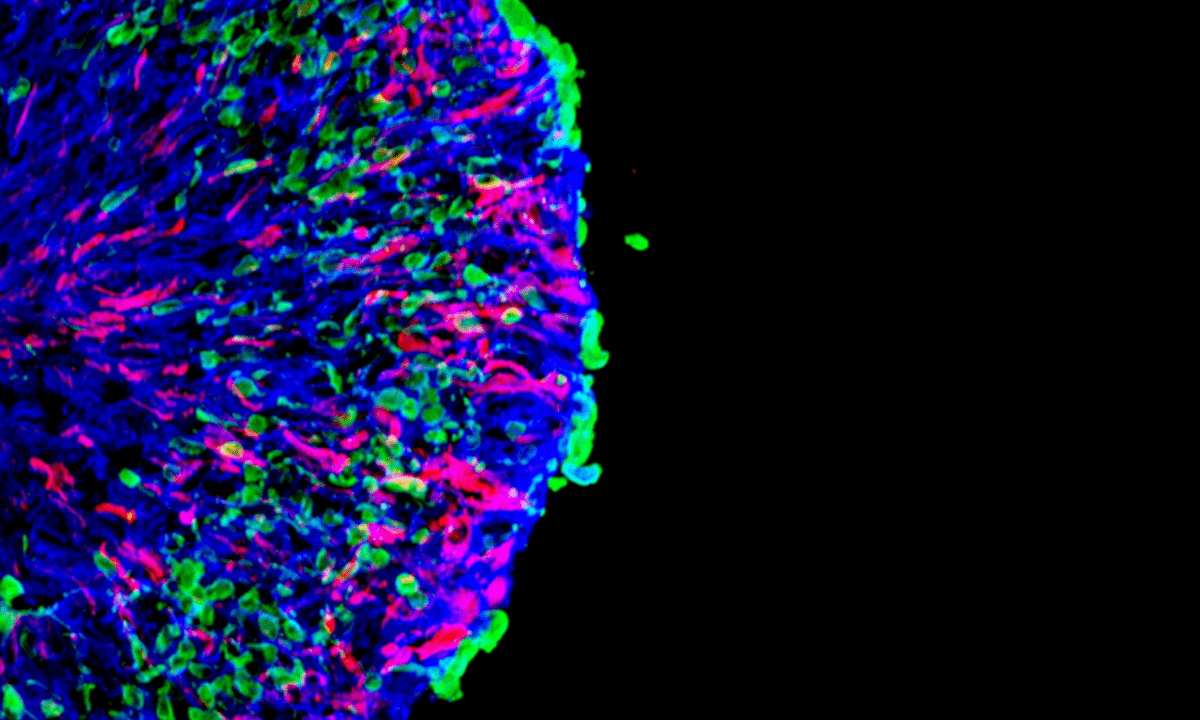
L: Gesundes Organoid. R: Organoid mit massiven Verlust von Photorezeptorneuronen (grün markiert). Rot markiert: pathologische Müller-Glia-Zellen, die in der gesunden Kontrollgruppe nicht vorhanden sind. © Völkner et al., Nat. Comm., 2022
Prinzip der Zell-Extrusion
Für die Forschenden begann eine aufwendige Fahndung nach den Ursachen. Dadurch landeten sie bei einer Studie aus dem Jahr 2012 (doi: 10.1038/nature10999): Jody Rosenblatt vom King’s College in London hatte damals erstmals die Extrusion lebender Zellen beschrieben – das mechanische Ausstoßen von Zellen aus einem Gewebe. Die dadurch außenliegenden Zellen sterben dann erst in Folge ab. Sie wies diesen Mechanismus an einfachen Epithelzellen der Niere nach. Mike Karl und sein Team zeigten jetzt in ihrer Pionierarbeit, dass diese Extrusion auch in der viel komplexeren Netzhaut ausgelöst werden kann und zu Degeneration führt. Schon zuvor fanden Forschende heraus, dass sich bei AMD-Patient:innen einige Zellen außerhalb der Netzhaut befanden. Die Ursache dafür war bislang allerdings nicht bekannt. Die Zell-Extrusion könnte jetzt die lange fehlende Erklärung liefern. „Dieses Prinzip, das als Zell-Extrusion bezeichnet wird, wurde bislang noch nicht bei neurodegenerativen Erkrankungen untersucht“, so der Leiter der Forschungsgruppe.
Während dieses Prozesses filmten die Forschenden die Organoide in Echtzeit; das sogenannte Live-Imaging gilt als Goldstandard, um Veränderungen von Zellen zu verfolgen. „Wir konnten die Degeneration von Photorezeptoren durch die Zell-Extrusion im Labor aufzeichnen“, sagt Prof. Karl. Die Forschenden fanden heraus, dass diese Extrusion durch Aktivierung des Proteins PIEZO1 ausgelöst wird, einem Sensor für biomechanische Kräfte.
Rolle der Biomechanik bei der Netzhaut-Degeneration
Dass die Biomechanik möglicherweise eine größere Rolle bei der Degeneration der Netzhaut spielen könnte, ist eine neue Erkenntnis. „Die Netzhaut ist nicht als biomechanisch aktives Gewebe wie etwa ein Muskel bekannt. Man wusste, dass Erkrankungen im Nervensystem mit Formveränderungen von Zellen einhergehen, aber inwieweit sie von biomechanischen Kräften reguliert werden, wurde bislang noch nicht untersucht“, konstatiert Prof. Karl.
Während es bei AMD-Patient:innen mehrere Jahre oder sogar Jahrzehnte dauert, bis Photorezeptoren verschwinden, konnte dieser Prozess im Labor jetzt in nur 40 Tagen nachvollzogen werden. Im nächsten Schritt wollen die Forschenden jetzt herausfinden, ob dieser Mechanismus in der Netzhaut beim Patienten genauso auftritt wie in den Organoiden. Erste Daten und viele inhaltliche Übereinstimmungen legen nahe, dass es sich um den gleichen Mechanismus handeln könnte, der Beweis steht allerdings noch aus.
„Wenn wir auf die Studien zurückblicken, in denen die Netzhäute von Patientinnen und Patienten analysiert wurden, können wir jetzt viele Veränderungen sehen, die auf diesen Mechanismus der Verdrängung der Photorezeptoren hindeuten. Dieser Prozess könnte daher möglicherweise bei der Alterung, der AMD und einigen erworbenen sowie vererbten Netzhauterkrankungen beteiligt sein", erklärt Prof. Karl. Es bleibt abzuwarten, ob die neue Beobachtung als potenzieller klinischer Biomarker und therapeutisches Ziel zur Verhinderung von Sehverlust genutzt werden kann.
Extrusion lässt sich verhindern
In ihrer Studie stellten die Dresdner Forschenden auch fest, dass sich die Extrusion unter Laborbedingungen im Modell verhindern lässt, wenn experimentelle Substanzen zum Einsatz kommen: Mit einem speziellen Schlangengift haben sie den Mechanosensor PIEZO1 auf den Zellen blockiert. In der Folge wurden nicht nur das Ausstoßen der Photorezeptoren, sondern auch weitere krankhafte Veränderungen in der Netzhaut verhindert. „Das macht Hoffnung auf die Entwicklung künftiger präventiver und therapeutischer Behandlungen für komplexe neurodegenerative Erkrankungen wie der AMD“, bilanziert Mike Karl.
Zusammenarbeit
Das Team betont, dass die Arbeit ohne Expert:innen aus Partnerinstitutionen und spezialisierte Forschungseinrichtungen nicht möglich gewesen wäre. Die langjährige Zusammenarbeit mit dem Team von Prof. Jörg Hackermüller an der Universität Leipzig und dem Helmholtz-Zentrum für Umweltforschung (UFZ) war entscheidend für die Studie. Das CRTD und das DZNE in Dresden bieten die Möglichkeit, modernste Ressourcen zu nutzen. „Durch die Zusammenarbeit mit Fachkräften aus den Bereichen Stammzelltechnik, Durchflusszytometrie, Next-Generation-Sequencing, Elektronen- und Lichtmikroskopie sowie Bildanalyse konnten wir mit diesem Projekt große Sprünge nach vorne machen", sagt Prof. Karl.
Über das Deutsche Zentrum für Neurodegenerative Erkrankungen (DZNE)
Das DZNE ist ein von Bund und Ländern gefördertes Forschungsinstitut, das bundesweit zehn Standorte umfasst. Es widmet sich Erkrankungen des Gehirns und Nervensystems wie Alzheimer, Parkinson und ALS, die mit Demenz, Bewegungsstörungen und anderen schwerwiegenden Beeinträchtigungen der Gesundheit einhergehen. Bis heute gibt es keine Heilung für diese Erkrankungen, die eine enorme Belastung für unzählige Betroffene, ihre Familien und das Gesundheitssystem bedeuten. Ziel des DZNE ist es, neuartige Strategien der Vorsorge, Diagnose, Versorgung und Behandlung zu entwickeln und in die Praxis zu überführen. Dafür kooperiert das DZNE mit Universitäten, Universitätskliniken und anderen Institutionen im In- und Ausland. Das Institut ist Mitglied der Helmholtz-Gemeinschaft und zählt zu den Deutschen Zentren der Gesundheitsforschung. www.dzne.de
Über das Zentrum für Regenerative Therapien Dresden (CRTD)
Am Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden widmen sich Spitzenforscher und -forscherinnen aus mehr als 30 Ländern neuen Therapieansätzen. Sie entschlüsseln die Prinzipien der Zell- und Geweberegeneration und ergründen deren Nutzung für Diagnose, Behandlung und Heilung von Krankheiten. Das CRTD verknüpft Labor und Klinik, vernetzt Wissenschaft und Klinik, nutzt Fachwissen in Stammzellforschung, Entwicklungs- und Regenerationsbiologie, um letztlich die Heilung von Erkrankungen wie Alzheimer und Parkinson, hämatologischen Krankheiten wie Leukämie, Stoffwechselerkrankungen wie Diabetes sowie Augen- und Knochenerkrankungen zu erreichen.
Das CRTD wurde 2006 als Forschungszentrum der Deutschen Forschungsgemeinschaft (DFG) gegründet und bis 2018 als DFG-Forschungszentrum, sowie als Exzellenzcluster gefördert. Seit 2019 wird das CRTD mit Mitteln der TU Dresden und des Freistaates Sachsen finanziert.
Das CRTD ist eines von drei Instituten der zentralen wissenschaftlichen Einrichtung Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden.
Originalpublikation:
Manuela Völkner, Felix Wagner, Lisa Maria Steinheuer, Madalena Carido, Thomas Kurth, Ali Yazbeck, Jana Schor, Stephanie Wieneke, Lynn J. A. Ebner, Claudia Del Toro Runzer, David Taborsky, Katja Zoschke, Marlen Vogt, Sebastian Canzler, Andreas Hermann, Shahryar Khattak, Jörg Hackermüller & Mike O. Karl: HBEGF-TNF induce a complex outer retinal pathology with photoreceptor cell extrusion in human organoids.
Nature Communications (Oktober 2022)