Kontrolliertes Herstellen, Lagern und Einfrieren von künstlichen Retina-Zellen
Fraunhofer-Forschenden ist es gelungen, eine Methode zur Herstellung und klinischen Anwendung von stammzellbasierten Retinaimplantaten zu entwickeln, die zu einer erfolgreichen Therapie von AMD beitragen könnte. Sie verfolgen dabei den Ansatz, das beschädigte Gewebe durch stammzellbasierte Transplantate zu ersetzen.

Kooperation mit der Augenklinik Sulzbach
Eine der größten Herausforderung bei der Arbeit mit humanen induzierten pluripotenten Stammzellen (hiPSC) stellt neben der Weiterentwicklung des Herstellungsprozesses derzeit noch die Langzeitlagerung sowie der Transport der Zellen dar. Im Rahmen des Projekts »KryoRet« untersuchten daher die Fraunhofer-Institute für Biomedizinische Technik IBMT, für Silicatforschung ISC, für Schicht- und Oberflächentechnik IST sowie das Fraunhofer-Translationszentrum für Regenerative Therapien TLZ-RT die technischen und biotechnologischen Voraussetzungen, um hiPSC-basierte Retina-Implantate effizienter herstellen und langfristiger lagern zu können. In diesem Zusammenhang kam insbesondere der Ausgestaltung des Kryobehälters sowie der Art der Kryokonservierung selbst eine besondere Bedeutung zu. Ein weiterer wichtiger Aspekt innerhalb des Projekts war die Qualitätskontrolle des Transplantats. Unterstützt wurden die Fraunhofer-Wissenschaftlerinnen und Wissenschaftler von Spezialisten der Augenklinik Sulzbach/Saar.
Gute Adhäsion der retinalen Pigmentepithel-Zellen an der Membran
Als physiologisches und funktionales Grundgerüst der Transplantate dient eine passgenaue Trägermembran, die im Labor hergestellt wird. Sie besteht aus ORMOCER®, d.h. anorganisch-organischen Hybridmolekülen, die mit Kieselgel-Fasern kombiniert werden, um die gewünschten Diffusionseigenschaften einzustellen und gleichzeitig eine gute Adhäsion der retinalen Pigmentepithel-Zellen (RPE) an der Membran sicherzustellen. Nur bei einer ausreichenden Haftung kann die Funktionalität der Zellen gewährleistet werden. Wie sich die Adhäsion der Zellen an der Membranoberfläche optimal durch eine Plasmabehandlung steuern lässt, wurde am Fraunhofer IST untersucht.
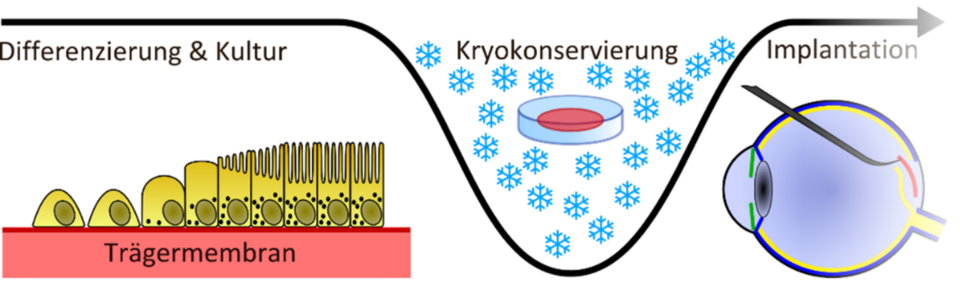
Bild: Fraunhofer IBMT
Insgesamt dauert es etwa 60 Tage, bis das implantationsfertige Gewebe vollständig aufgebaut ist. Es sind also sichere Lagerungstechnologien für die künstlichen RPE-Zellen erforderlich, bei denen die Qualität und Vitalität der Zellen erhalten bleibt. Die Zellen sollten dazu in einem Kryobehälter kontrolliert und schonend eingefroren werden, ohne dass ihre Struktur zerstört wird. Um dies zu erreichen, experimentierten die Forschenden des Fraunhofer IST mit verschiedenen Schichtbildnern. Mit einem Plasmajet wurden im Kryobehälter lokal adhäsive Schichten aufgebracht, an die sich Partikel anlagern, die ihrerseits als Nukleationskeime für den Phasenübergang von Wasser zu Eis dienen. Ein Ziel der Versuche war es, den Kristallisationsprozess der Eisbildung beim Einfrieren in dem Kunststoffbehälter durch Beschichtungen gezielt zu steuern und ein optimales Kryoprotokoll zu entwickeln.
KI soll helfen, die Qualität der Zellen sicherzustellen
Gleichzeitig muss stets die Qualität der Zellen sichergestellt werden. Während des gesamten Prozesses darf es zu keiner Beschädigung des Implantats selbst kommen. Am Fraunhofer IST wurde daher untersucht, inwieweit Methoden des maschinellen Lernens in einem nichtinvasiven bildbasierten Verfahren zur Bewertung der RPE-Zellen hinsichtlich ihrer Qualität und Funktionalität eingesetzt werden können. Das für das Training der KI notwendige Bildmaterial mit unterschiedlichen Entwicklungsphasen der RPE-Zellen in verschiedenen Qualitäten wurde von den Projektpartnern, dem Fraunhofer IBMT und dem Fraunhofer ISC, zur Verfügung gestellt. Derartige Methoden der Bildbewertung können perspektivisch auch auf andere Anwendungsbereiche übertragen werden. Kern ist eine im Rahmen des Aufbaus einer digitalen Infrastruktur am Fraunhofer IST programmierte Software zur KI-unterstützten Bildauswertung.
Quelle: Fraunhofer-Institut für Schicht- und Oberflächentechnik IST