Durchbruch in der Therapie des Morbus Basedow
Mit den IGF1R-Blockern beginnt ein neues Zeitalter bei der Therapie der endokrinen Orbitopathie (EO). Ein Statement von Prof. Anja Eckstein (Universitätsaugenklinik Essen) anlässlich der DOG.
1840 beschrieb Carl Adolph von Basedow die später im deutschsprachigen Raum nach ihm benannte Krankheit. Basedow lebte zu dieser Zeit als praktischer Arzt und Chirurg in Merseburg. Die kennzeichnenden Merkmale der sogenannten Glotzaugen-Kachexie werden in der Medizin bis heute als Merseburger Trias bezeichnet. Die Trias umfasst die hervortretenden Augen, die vergrößerte Schilddrüse und den beschleunigten Herzschlag.
Es handelt sich um eine Autoimmunerkrankung, die sich im mittleren Lebensalter wesentlich häufiger bei Frauen als bei Männern manifestiert. Circa die Hälfte der Patientinnen und Patienten, die an dieser Form der Schilddrüsenüberfunktion erkranken, entwickeln auch Augensymptome – die endokrine Orbitopathie (EO). Die Inzidenz liegt für die Orbitopathie bei Frauen zwischen 3,3 und 16/100.000 Einwohner/Jahr und bei Männern von 0,9 bis 2,9/100.000 Einwohner pro Jahr.
Die Patienten, die an einer Basedow-Erkrankung leiden, haben Autoantikörper im Blut, die den sogenannten TSH-Rezeptor (Thyreotropin) in der Schilddrüse stimulieren und so eine Überfunktion induzieren. Viele Patienten verlieren durch die Überfunktion erheblich an Gewicht (Kachexie) und das Herz schlägt durch die Überfunktion schneller (Tachykardie).
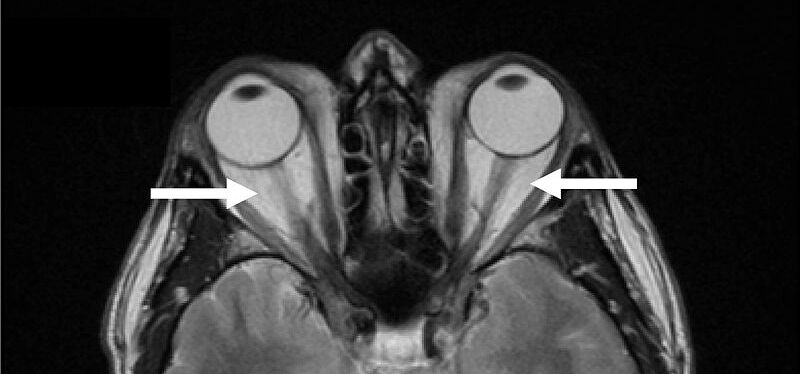
Vor noch nicht allzu langer Zeit wurde entdeckt, dass diese Autoantikörper im Augenhöhlenbindegewebe gleich zwei Rezeptoren stimulieren. Einmal den TSH- (Thyreotropin-) Rezeptor und einen Rezeptor, der normalerweise von IGF1 (IGF1 = insulinähnlicher Wachstumfaktor 1) angeschaltet wird. Dadurch werden die wesentlichen Krankheitsprozesse der endokrinen Orbitopathie in Gang gesetzt: Fettvermehrung und Hyaluronsäureproduktion.
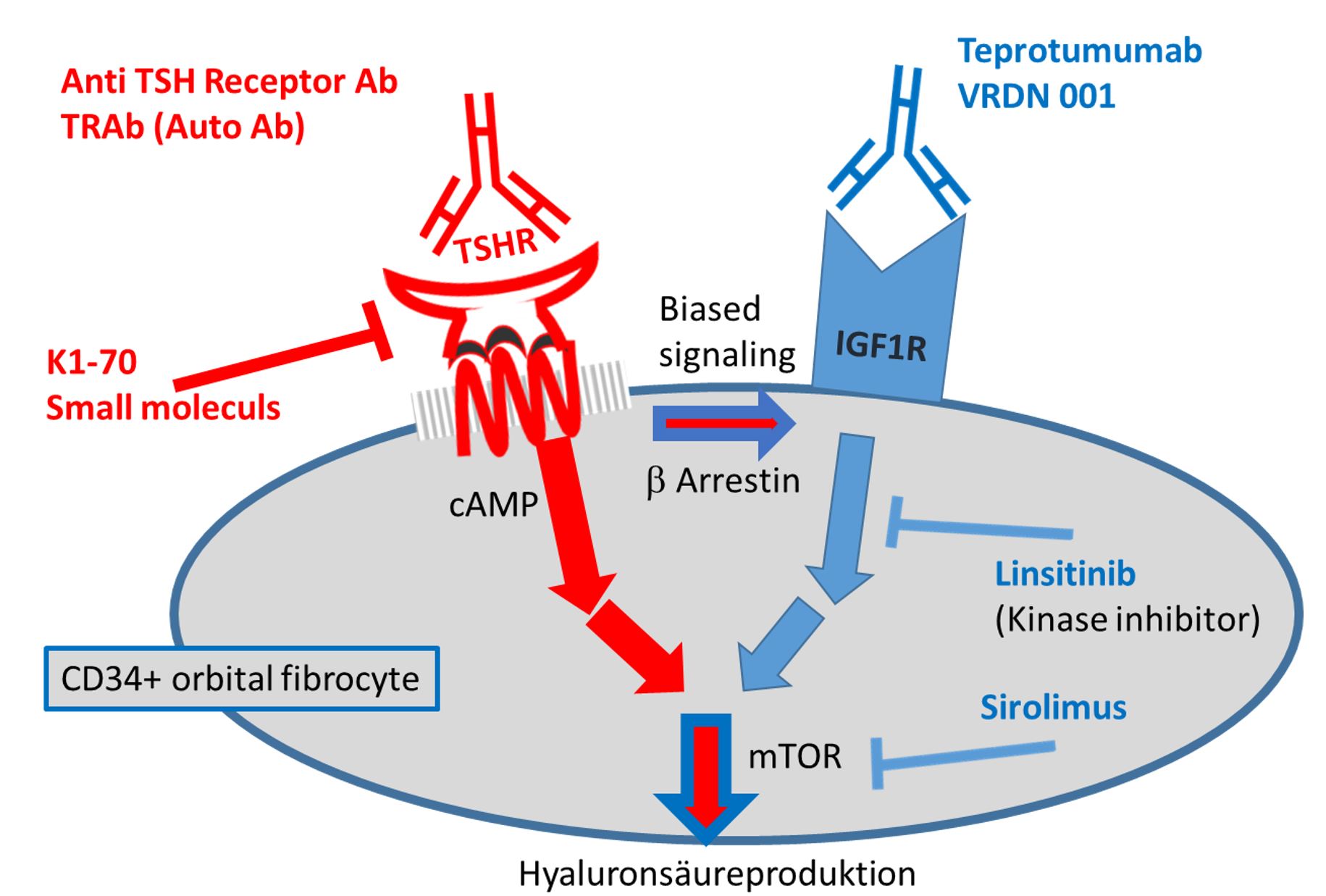 |
Patienten mit Morbus Basedow haben Anti TSHR Auto Antikörper im Blut. Diese binden an den TSHR der auch auf Bindegewebszellen der Augenhöhle vorkommt. Die Autoantikörper induzieren ein sogenanntes cross talk zu dem Wachstumsfaktorrezeptor IGF1R (Insulin ähnlicher Wachstumsfaktor Rezeptor 1). Über beide Rezeptoren, v.a. über IGF1R, wird eine krankhaft vermehrte Hyaluronsäureproduktion angeschaltet, was zu Wassereinlagerung, Schwellung, Hervortreten der Augen und Muskelvernarbung führt. 2020 wurde als Behandlung der IGF1R Blocker Teprotumumab zugelassen, der eine exzellente Wirkung induziert (Rückbildung der Bindegewebszunahme, Auflösung der Vernarbung) |
Hyaluronsäure kennt man als sogenanntes Filler-Präparat. Filler können durch ihr Volumen Falten glätten. In der knöchern begrenzten Augenhöhle sind sie fehl am Platz. Die Volumenvermehrung durch Fett und Hyaluronsäure schiebt die Augäpfel nach vorne (Exophthalmus → Glotzaugen). Die Augenmuskeln vertragen die Hyaluronsäure auch nicht, sie verdicken sich und vernarben. Dadurch wird die Beweglichkeit der Augäpfel schlechter.
Und da nicht alle Augenmuskeln gleichzeitig befallen sind, stehen die Augen dann oft in einer Schielstellung. Die Folge ist Diplopie → Doppeltsehen. Durch die Wassereinlagerung bekommen die Patienten auch mehr oder weniger ausgeprägte Lidschwellungen. Die Lebensqualität der Patienten wird durch die äußere Entstellung und die Funktionseinbußen sehr stark herabgesetzt.
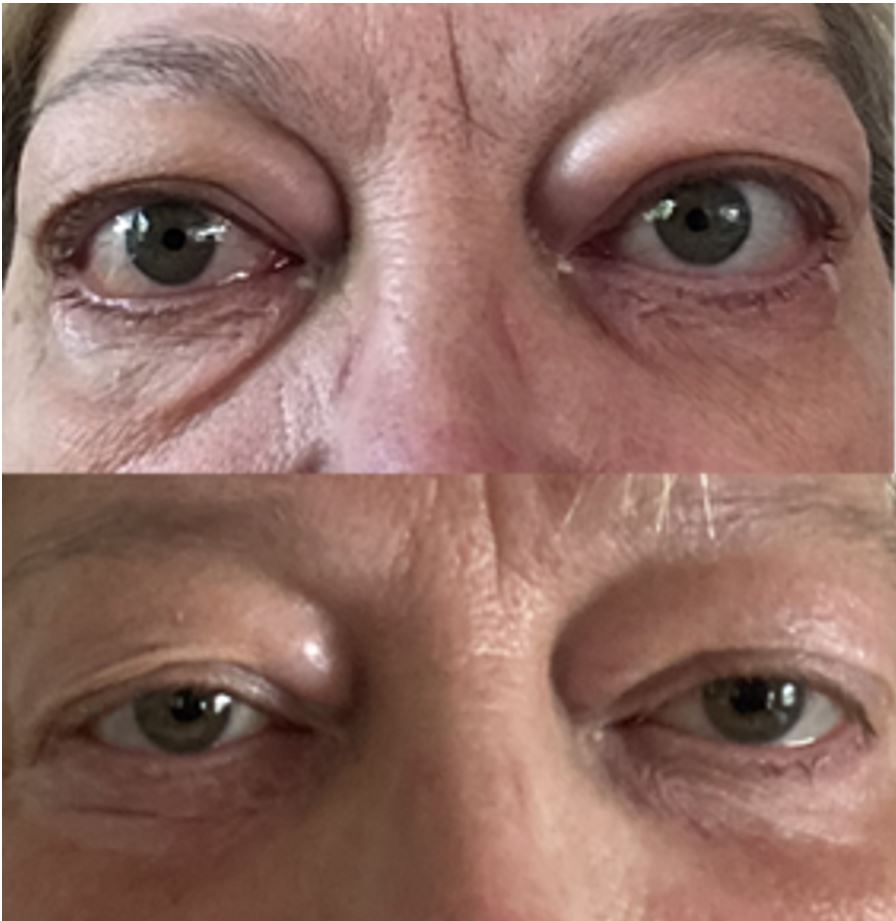
Nun wurde in den USA erstmals ein therapeutischer Antikörper zugelassen, der den IGF1- Rezeptor direkt blockiert und damit die krankhafte Hyaluronsäureproduktion im Gewebe stoppt (Teprotumumab). Der Antikörper ist sehr wirksam, schon nach wenigen Infusionen verschwinden die Glotzaugen, das heißt, die Augäpfel gehen wieder in die Augenhöhlen zurück. Das ist ein Behandlungseffekt, der mit den üblichen Behandlungsstrategien (Immunsuppression) bisher nicht erreicht werden konnte.
Erste in unserem Zentrum behandelte Patientin, oben vor der Therapie und unten nach 4 Infusionen mit Teprotumumab.
Bei den bisherigen Behandlungsstrategien bei Autoimmunerkrankungen handelt es sich durchweg um immunsuppressive Maßnahmen, das heißt, es wird im Wesentlichen ein antientzündlicher Effekt erreicht. Das einmal abgelagerte Bindegewebe wird aber kaum aufgelöst, sodass die Glotzaugen bleiben und auch die Doppelbilder.
Aus diesem Grund müssen bisher bei stärker betroffenen Patienten später im Verlauf Korrekturoperationen durchgeführt werden. Diese darf man aber erst machen, wenn die Krankheitsdynamik zum Stillstand gekommen ist. Meist dauert das 1 bis 1,5 Jahre. Um die hervorgetretenen Augen zu korrigieren, werden Knochenwände der Augenhöhle chirurgisch entfernt, damit das Zuviel an Augenhöhlengewebe zur Seite weichen kann und die Augäpfel wieder in die Augenhöhle einsinken (knöcherne Dekompression).
Diese Operation ist natürlich nicht ohne Risiko für den Patienten – Schielstellungen können sich neu entwickeln oder verschlechtern. Die Korrektur der schielenden Augen ist ebenfalls nicht einfach, da die Augen in drei Dimensionen verdreht sein können. So werden oft mehrere Operationen notwendig, bis die Augen sich wieder einigermaßen symmetrisch bewegen, Doppelbilder verschwinden und der Patient wieder normal aussieht.
Mit dem Einsatz der IGF1R-Blocker wird ein neues Zeitalter für die Patienten beginnen, da viele Korrekturoperationen dann nicht mehr oder in signifikant geringerem Ausmaß durchgeführt werden müssen, um Aussehen und Sehfunktion wiederherzustellen.

Prof. Dr. Anja Eckstein. Bild Universitätsklinikum Essen
Leider ist die Wirkung eines Arzneimittels immer auch mit Nebenwirkungen assoziiert. Wenn der wichtige insulinähnliche Wachstumsfaktor-1-Rezeptor blockiert wird, werden insulinähnliche Wirkungen blockiert. Der Blutzucker steigt deshalb an, sodass vor allem bei Diabetikern Einschränkungen in der Anwendbarkeit bestehen. Weiterhin spielt IGF1 bei der neuronalen Regeneration insbesondere im Innenohr eine Rolle, sodass bei 10 bis 14 Prozent der Patienten Hörstörungen auftreten können. Vor diesem Hintergrund ist es besonders interessant, dass inzwischen weitere Medikamente entwickelt wurden, die die direkte Antikörperwirkung blockieren (TSHR blockierende Antikörper/kleine Moleküle bzw. Substanzen, die selektiv die Autoantikörper im Blut wegfangen).
Der niedrig molekulare IGF1R Antagonist Linsitinib zeigte im präklinischen Modell noch zusätzlich nützliche Eigenschaften, da Linsitinib zusätzlich zur Hemmung der Hyaluronsäureproduktion auch die Knochenmarkaktivierung hemmt und somit wahrscheinlich zu einem schnelleren Ende der Autoimmunerkrankung beiträgt. Dazu kommt, dass man Linsitinib oral mit kurzer Halbwertszeit verabreichen kann, sodass die Therapie besser steuerbar ist.
Mit den IGF1R/TSHR blockierenden Therapien wird ein neues Zeitalter in der Therapie der Basedow-Schilddrüsen- und -Augenerkrankung anbrechen. In relativ kurzem Zeitraum verschwinden Exophthalmus (Glotzaugen) und Augenbewegungsstörung mit Diplopie (Doppeltsehen). Bisher können diese Symptome erst nach längerer Wartezeit (1 Jahr oder länger) im inaktiven Stadium der Erkrankung operativ und oft auch nicht immer vollständig korrigiert werden.
Allerdings stellen die hohen Kosten für solche Therapien für das deutsche Gesundheitssystem eine zunehmende Herausforderung dar. In der Kosten-Nutzen Bewertung sollte hier die signifikante Verkürzung der Dauer der Arbeitsunfähigkeit insbesondere durch Doppelbilder miteinbezogen werden. Da die Medikamente noch nicht von der EMA zugelassen wurden, können Patienten in Deutschland diese Medikamente nur in Studienzentren erhalten: VRDN 001: Berlin: Charité, Dresden: Universitätsklinikum, Göttingen: UMG, Essen UME (alles Augenkliniken), Teprotumumab: Essen UME (Augen), Mainz UNI (Endokrinologie), Linsitinib bisher nur in Europa, aber nicht in Deutschland.
Prof. Dr. Anja Eckstein
Stellvertretende Direktorin der Klinik für Augenheilkunde; Leiterin Orthoptik, Orbitazentrum, okuloplastisch rekonstruktive Chirurgie, Universitätsklinikum Essen
Leiterin der AG Entzündliche Orbitaerkrankungen
Literatur
1. Smith, T.J., Understanding Pathogenesis Intersects With Effective Treatment for Thyroid Eye Disease. J Clin Endocrinol Metab, 2022. 107(Suppl_1): p. S13-S26.
2. Girnita, L., T.J. Smith, and J. Janssen, It Takes Two to Tango: IGF-I and TSH Receptors in Thyroid Eye Disease. J Clin Endocrinol Metab, 2022. 107(Suppl_1): p. S1-S12.
3. Douglas, R.S., et al., Teprotumumab Efficacy, Safety, and Durability in Longer-Duration Thyroid Eye Disease and Re-treatment: OPTIC-X Study. Ophthalmology, 2022. 129(4): p. 438-449.
4. Douglas, R.S. and G.J. Kahaly, Teprotumumab for Active Thyroid Eye Disease. Reply. N Engl J Med, 2020. 382(20): p. 1959-1960.
5. Burch, H.B., et al., Management of Thyroid Eye Disease: A Consensus Statement by the American Thyroid Association and the European Thyroid Association. Thyroid, 2022. 32(12): p. 1439-1470.
6. Gulbins, A., et al., Linsitinib, an IGF-1R inhibitor, attenuates disease development and progression in a model of thyroid eye disease. Front Endocrinol (Lausanne), 2023. 14: p. 1211473.