Ursprung der Makrophagen im Glaskörper des Auges aufgeklärt
Ein Team um den Augsburger Zellbiologen und Anatom Prof. Dr. Peter Wieghofer hat nachgewiesen, dass sich Makrophagen im Glaskörper des Auges bereits im Embryonalstadium entwickeln. Bislang wurde vermutet, dass sie sich im Verlauf des Lebens regelmäßig aus Blutzellen neu bilden. Diese Erkenntnis ist wichtig für die Behandlung von Krankheiten wie der diabetischen Retinopathie.
Als Teil unseres Immunsystems vernichten Makrophagen Krankheitserreger. Man findet sie im Blutkreislauf und in allen Organen. An der Medizinischen Fakultät der Universität Augsburg hat ein Team von Forschenden unter Leitung von Prof. Dr. Peter Wieghofer, Professor für Zelluläre Neuroanatomie, nun neue Erkenntnisse zu diesen wichtigen Immunzellen im Auge gewonnen.
Sie wiesen erstmals nach, dass sich die Makrophagen im Glaskörper des Auges der Maus bereits im Embryonalstadium ansiedeln. Stand der Forschung war jahrzehntelang, dass diese sogenannten Hyalozyten – die schon zu Zeiten Rudolf Virchows erforscht wurden – sich regelmäßig aus Blutzellen neu bilden. Die Forschungsergebnisse wurden nun im Journal of Neuroinflammation veröffentlicht.
Hoffnung bei diabetischer Retinopathie
„Die Makrophagen im Glaskörper entwickeln sich also schon vor der Geburt, besiedeln den Glaskörper und verbleiben dort ein Leben lang, genau wie die Makrophagen der an den Glaskörper angrenzenden Netzhaut, die sogenannten Mikroglia“ erklärt Wieghofer. Weil sie sich nicht – wie bislang angenommen – aus Zellen im Blut erneuern, können immunologische Alterungs-Vorgänge zu einer Funktionsstörung dieser Zellen führen und so zur Entwicklung von Erkrankungen des Glaskörpers und der Netzhaut beitragen.
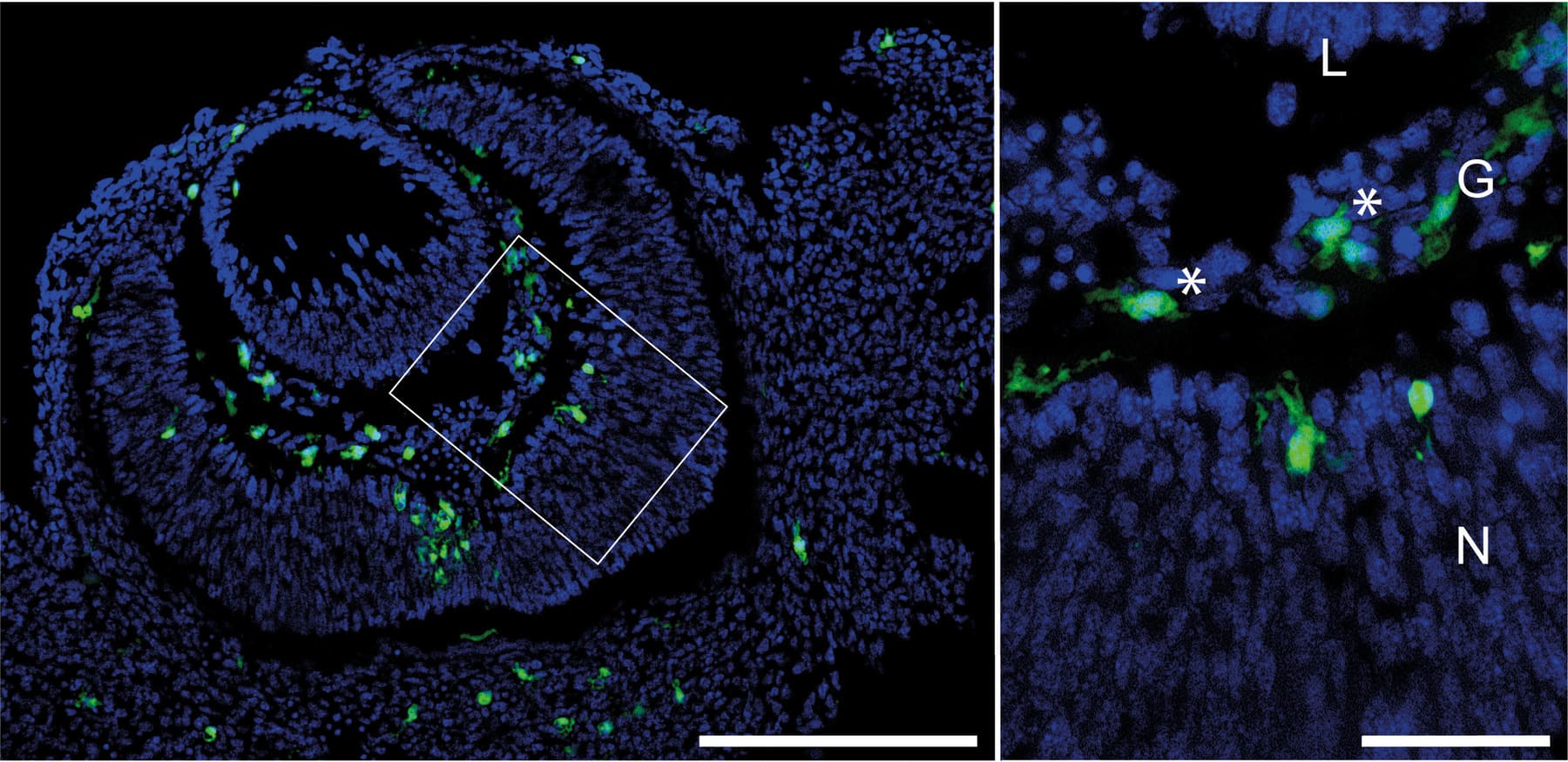
Repräsentativer Schnitt durch das sich entwickelnde Mausauge. Fresszellen sind in Grün dargestellt, Hyalozyten im Glaskörper mit einem Stern (*) markiert. Abkürzungen: L – Linse, G – Glaskörper, N- Neuroretina. Modifiziert nach Rosmus et al., J. Neuroinflammation 2024 (lizensiert nach Creative-Commons CC-BY-4.0).
„Was wir gemacht haben, ist Grundlagenforschung“, sagt Wieghofer. Die Entdeckung kann ein Ansatz sein für Therapien aller Erkrankungen, welche die Hyalozyten im Glaskörper, aber auch die Netzhaut betreffen, wie zum Beispiel die diabetische Retinopathie und die proliferative Vitreoretinopathie.
„Auch hier bieten die neuen Erkenntnisse zu Hyalozyten einen interessanten Ansatz für potenzielle Therapien. Je besser wir also die grundlegenden Eigenschaften dieser Zellen verstehen, umso eher können wir auf Erkrankungen der Grenzfläche zwischen Netzhaut und Glaskörper einwirken, können den Schweregrad solcher Erkrankungen reduzieren und das Leben von Patienten nachhaltig positiv beeinflussen.“
Quelle: Universität Augsburg
Originalpublikation:
“Redefining the ontogeny of hyalocytes as yolk sac-derived tissue-resident macrophages of the vitreous body”. Dennis-Dominik Rosmus, Jana Koch, Annika Hausmann, Aude Chiot, Franz Arnhold, Takahiro Masuda, Katrin Kierdorf, Stefanie Marie Hansen, Heidrun Kuhrt, Janine Fröba, Julian Wolf, Stefaniya Boneva, Martin Gericke, Bahareh Ajami, Marco Prinz, Clemens Lange & Peter Wieghofer
Journal of Neuroinflammation volume 21, Article number: 168 (2024).
