Brolucizumab und die okklusive retinale Vaskulitis
Zulassung erteilt für ein einkettiges Antikörperfragment im Rahmen von einer Behandlung neovaskulärer altersbedingter Makuladegeneration.
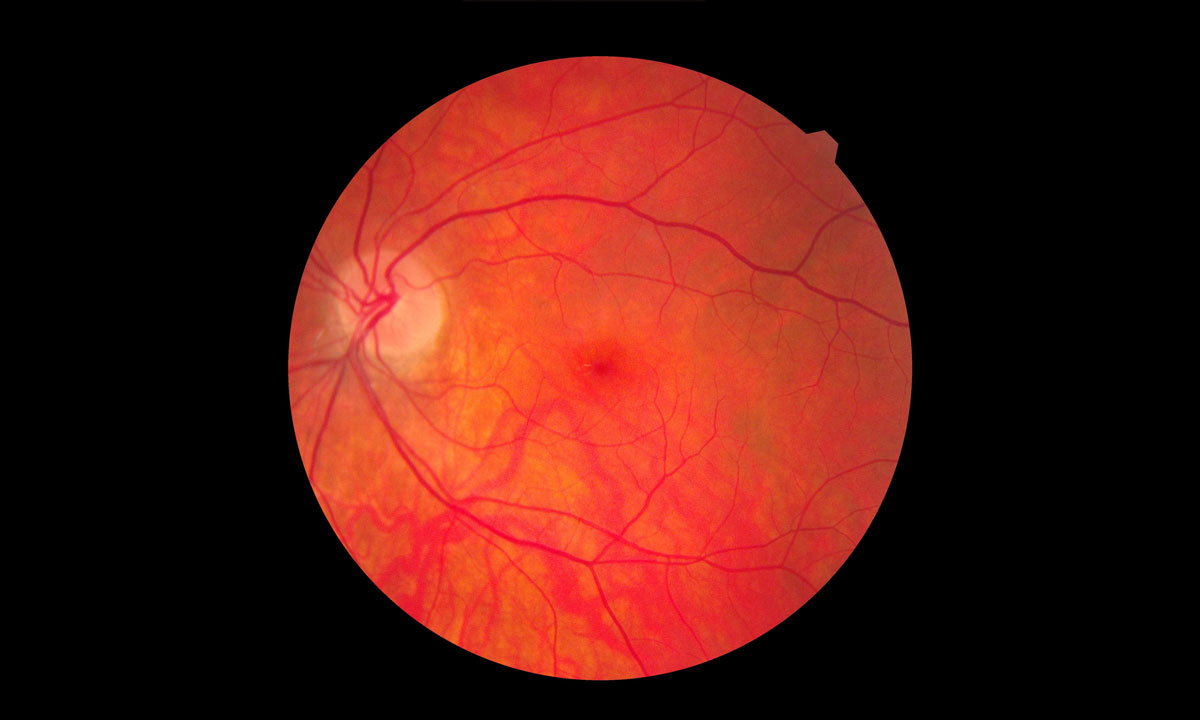
Brolucizumab wurde u.a. mit dem Ziel entwickelt, die Sehfähigkeit bei Patientinnen und Patienten mit einer symptomatischen neovaskulären altersbedingten Makuladegeneration zu verbessern und gleichzeitig die Behandlungslast zu minimieren.
Am 7. Oktober 2019 erhielt Brolucizumab (Beovu®, Novartis International AG) von der US-amerikanischen Food and Drug Administration (FDA) die Zulassung zur Behandlung der neovaskulären altersbedingten Makuladegeneration. Brolucizumab ist ein einkettiges Antikörperfragment, welches die Fähigkeit besitzt alle Formen des endothelialen Gefäßwachstumsfaktors VEGF-A zu blockieren. Seine geringe Molekulargröße und seine hohe Löslichkeit haben es möglich gemacht den Wirkstoff in einer höheren Dosierung zu konzentrieren. In den Phase-3-Studien HAWK und HARRIER konnte gezeigt werden, dass bei rund der Hälfte der Studienteilnehmer und Studienteilnehmerinnen eine Visusverbesserung durch eine Behandlung mit Brolucizumab im 12-Wochenintervall erreicht werden konnte. Bereits kurz nach der Zulassung durch die FDA erhielt die die American Society of Retina Specialists (ASRS) die ersten Berichte über das Auftreten von okulären Inflammationsprozessen nach intravitrealer Brolucizumab-Injektion zur Behandlung der neovaskulären altersbedingten Makuladegeneration. Neben intraokulären Entzündungen wurde auch von Fällen mit retinaler Vaskulitis berichtet. Im schlimmsten Fall kam es zu einer okklusiven retinalen Vaskulitis mit einem erheblichen Sehverlust.1
MERLIN, RAPTOR und RAVEN wurden vorzeitig abgebrochen
Am 28. Mai dieses Jahres hat Novartis die Ein-Jahres-Ergebnisse der Phase-III-MERLIN-Studie zur Evaluierung der intraokulären Injektionstherapie mit Brolucizumab im 4-Wochenrhytmus veröffentlicht. Der primäre Endpunkt der MERLIN-Studie wurde erreicht. Die Verabreichung von Brolucizumab im 4-Wochenrhytmus ging jedoch -verglichen mit Aflibercept- mit einer höheren Rate an intraokulären Inflammationsprozessen einher.
Hierzu zählten auch die retinale Vaskulitis, sowie retinale Gefäßverschlüsse. Novartis beendete daraufhin die MERLIN-Studie vorzeitig mit der Begründung, dass die Sicherheit der Patienten von höchster Bedeutung ist. Neben der MERLIN-Studie wurden auch die RAPTOR- und RAVEN-Studie vorzeitig abgebrochen. Die beiden letzteren Studien, haben die Wirksamkeit und Sicherheit von Brolucizumab bei retinalem Venenverschluss untersucht. Die Beovu®-Verschreibungsinformationen hinsichtlich der vierwöchentlichen Dosierung von Brolucizumab werden aktuell weltweit angepasst.1,2-4
Retinale Arterien sind am häufigsten betroffen
Genau vor einem Jahr veröffentlichte die Forschungsgruppe um Andre J. Witkin ihre Analyse verschiedener Fälle von retinaler Vaskulitis, die der American Society of Retina Specialists (ASRS) zuvor gemeldet worden waren. In dieser Fallserie lag eine retinale Vaskulitis bei 26 Augen von 25 Patienten und Patientinnen vor. Das weibliche Geschlecht überwog mit 88%. Rund 92% der Fälle waren mit einer intraokulären Entzündung assoziiert gewesen. Diese trat im Mittel 25 Tage nach der letzten Brolucizumab-Injektion auf. Vor der Behandlung lag die mittlere Sehschärfe bei 20/52 (nach Snellen). Nach dem Eintritt des unerwünschten Ereignisses fiel diese auf 20/151 (nach Snellen), um schließlich bei der letzten Follow-up-Untersuchung einen Wert von 20/243 (nach Snellen) zu erreichen. Die Forschungsgruppe führte eine Analyse der retinalen Bildgebung durch. Bei 83% der betroffenen Augen war eine Okklusionskrankheit erkennbar gewesen. Die Vaskulopathie betraf die retinalen Arterien mit 91%, die retinalen Venen mit 79% und die choroidalen Gefäße mit 48%.5
Bei okklusiver retinaler Vaskulitis nach Brolucizumab-Injektion liegt das Risiko für einen schweren Sehschärfeverlust bei rund 22%
Im November 2020 hat ein unabhängiges Safety Review Committee (SRC), die von den Prüfärzten gemeldeten Fälle (HAWK und HARRIER) von intraokularen Entzündungen, Endophthalmitis und retinalen Arterienverschlüssen analysiert. Dieses Komitee wurde von der Novartis Pharma AG unterstützt. Die Post-hoc-Analyse ergab folgendes Ergebnis: Bei 50 der 1088 mit Brolucizumab behandelten Augen kam es zu einem intraokulären Entzündungsprozess, zu einer retinalen Vaskulitis und/oder zu einem Gefäßverschluss. Es handelte sich hierbei um arzneimittelbedingte unerwünschte Ereignisse. Die Inzidenz für einen intraokulären Entzündungsprozess lag bei 4,6%. In Kombination mit einer retinalen Vaskulitis lag die Inzidenz bei 3,3%. Die Kombination aus intraokulärem Entzündungsprozess, retinaler Vaskulitis und Okklusion besaß eine Inzidenz von 2,1%. Das Risiko für einen schweren Sehschärfeverlust lag bei Vorliegen einer retinalen Vaskulitis bei 13,9% und bei gleichzeitigem Vorhandensein eines retinalen Gefäßverschlusses bei 21,7%.6
Expertenempfehlung zum Management von intraokularen Entzündungen, retinaler Vaskulitis und Gefäßverschlüssen nach Brolucizumab-Injektion
Im Juni dieses Jahres wurde ein wissenschaftlicher Artikel publiziert, der die Expertenmeinung zum Management von intraokularen Entzündungen, retinaler Vaskulitis und Gefäßverschlüssen nach Brolucizumab-Behandlung zum Thema hatte. Die Arbeitsgruppe bestand aus internationalen medizinischen Experten, sowie medizinischem Personal der Novartis Pharma AG. Die Arbeitsgruppe empfiehlt folgendes Vorgehen: Die Patienten sollten dazu angehalten werden, relevante oder anhaltende Symptome nach dem Auftreten einer intraokulären Entzündungsreaktion umgehend zu melden, um eine rechtzeitige Intervention ermöglichen zu können. Bei Patienten mit einer intraokulären Entzündungsreaktion nach Brolucizumab-Injektion sollte die Netzhaut gründlich untersucht werden. Hierbei sollte bei der klinischen Untersuchung vor allem auf Anzeichen einer retinalen Vaskulitis und/oder eines retinalen Gefäßverschlusses geachtet werden. Diese Untersuchung kann durch multimodale bildgebende Verfahren ergänzt werden. Bei Bestätigung einem dieser arzneimittelbedingten unerwünschten Ereignisse sollte die laufende Brolucizumab-Behandlung unterbrochen werden. Gleichzeitig sollte eine intensive Kortikosteroidtherapie (topisch, subtenon, intravitreal oder systemisch) begonnen werden.
Entscheidend für den Verlauf ist die frühzeitige Diagnosestellung und die rechtzeitige korrekte Intervention. Die betroffenen Patientinnen und Patienten sollten weiterhin regelmäßig ophthalmologisch überwacht werden.7
Was könnte diesem seltenen und komplexen Phänomen zugrunde liegen?
Bei der Analyse der Daten der Patientinnen und Patienten mit einer intraokulären Entzündungsreaktion bis hin zu retinalen Gefäßverschlüssen konnten folgende Beobachtungen gemacht werden:
- · Das weibliche Geschlecht überwog
- · Die Patientinnen und Patienten waren zuvor bereits mit einem anderen Anti-VEGF-Präparat behandelt worden
- Die retinale Vaskulitis trat meist erst Wochen nach den ersten Anzeichen einer intraokulären Entzündungsreaktion auf
- Der intraokulären Entzündung und der retinalen Vaskulitis lag keine Infektion bzw. Endophthalmitis zugrunde
Das umfangreiche Uveitis-Work-up war in den publizierten Fällen negativ gewesen. Brolucizumab weist einige Besonderheiten im Vergleich zu den anderen Anti-VEGF-Präparaten auf. Es besitzt keinen Fc-Teil und hat eine sehr geringe Molekulargröße. Die vor der Behandlung vorhandenen Anti-Drug-Antikörper waren bei Brolucizumab -verglichen mit den anderen Anti-VEGF-Präparaten- am häufigsten vorgekommen. Bei 35-52 % der therapienaiven Patienten waren diese gegen Brolucizumab gerichteten Anti-Drug-Antikörper vorhanden gewesen. Bei Ranibizumab und Aflibercept lagen diese Anti-Drug-Antikörper nur bei 5% der Patientinnen und Patienten vor. Bei den besagten arzneimittelbedingten unerwünschten Ereignissen könnte es sich um einen Autoimmunprozess handeln. Das weibliche Geschlecht besitzt ein höheres Risiko für das Auftreten von Autoimmunerkrankungen. Bei 8 der 15 Patientinnen lag eine Multipler Sklerose, eine Arthritis oder ein Diabetes mellitus vor. Die systemischen Immunreaktionen bei den genannten Patientinnen könnten einen prädisponierenden Effekt für das Auftreten einer retinalen Vaskulitis nach Brolucizumab-Injektion besitzen. Iyer et al. zufolge sind die arzneimittelbedingten unerwünschten Ereignissen mit einer Typ-IV-Hypersensitivitätsreaktion assoziiert. Zu diesem Schluss kam die Forschungsgruppe nach der Analyse der Glaskörperbiopsien der betroffenen Augen.8,9
Referenzen:
- https://www.novartis.com/news/media-releases/novartis-reports-one-year-results-phase-iii-merlin-study-evaluating-beovu-every-four-week-dosing-and-provides-update-beovu-clinical-program
- Assessing the efficacy and safety of brolucizumab versus aflibercept in patients with visual impairment due to macular edema secondary to branch retinal vein occlusion (RAPTOR). https://clinicaltrials.gov/ct2/show/NCT03802630. Accessed May 28, 2021.
- Assessing the efficacy and safety of brolucizumab versus aflibercept in patients with visual impairment due to macular edema secondary to central retinal vein occlusion (RAVEN). https://clinicaltrials.gov/ct2/show/NCT03810313. Accessed May 28, 2021.
- Study of safety and efficacy of brolucizumab 6 mg dosed every 4 weeks compared to aflibercept 2 mg dosed every 4 weeks in patients with retinal fluid despite frequent anti-VEGF injections (MERLIN). https://clinicaltrials.gov/ct2/show/NCT03710564. Accessed May 28, 2021.
- Witkin A. J. et al. (2020). Occlusive Retinal Vasculitis Following Intravitreal Brolucizumab. J Vitreoretin Dis. 2020;4(4):269-279.
- Monés J. et al. (2021). Risk of Inflammation, Retinal Vasculitis, and Retinal Occlusion–Related Events with Brolucizumab. Vol. 128, Issue 7, p1050-1059.
- Baumal C. R. et al. (2021). Expert Opinion on Management of Intraocular Inflammation, Retinal Vasculitis, and Vascular Occlusion after Brolucizumab Treatment. Vol. 5, Issue 6, p519-527.
- Sharma A. et al. (2021). Understanding Retinal Vasculitis Associated with Brolucizumab: Complex Pathophysiology or Occam’s Razor?, Ocular Immunology and Inflammation.
- Iyer P. G. et al. (2020). Brolucizumab-related retinal vasculitis with exacerbation following ranibizumab retreatment: a clinicopathologic case study. Am J Ophthalmol Case Rep. 2020;20:100989.